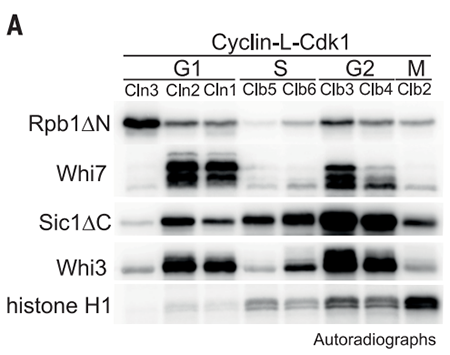
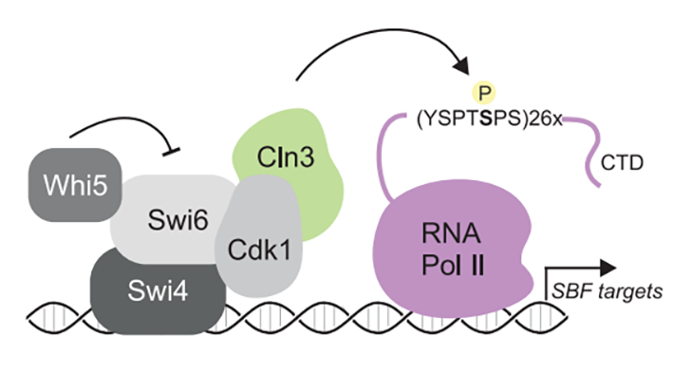
细胞周期蛋白(Cyclin)与细胞周期蛋白依赖性激酶Cdk(Cyclin-dependent kinases)是调控不同细胞周期时相的关键组合。细胞周期的第一步从G1期到S期的过渡需要转录抑制因子的失活。在酵母中,G1期的cyclin Cln3-Cdk1复合体被认为直接磷酸化Whi5蛋白,从而释放转录因子SBF,促进细胞进入细胞周期。但是尚未有体内的证据证明Cln3-Cdk1复合体直接磷酸化Whi5蛋白【1】。因此,真核细胞中G1-S期的转换模型是如何进展的尚未可知。为了对这一问题的答案进行探究,美国斯坦福大学Jan M. Skotheim研究组在Science发文题为G1 cyclin-Cdk promotes cell cycle entry through localized phosphorylation of RNA polymerase II,发现G1-S期过渡相关的cyclin-Cdk并非通过Whi5蛋白而是通过调节RNA Pol II的磷酸化促进细胞周期进入。为了检测Cln3-Cdk1是否真的磷酸化Whi5,作者们使用了Phos-tag的蛋白胶【2】对磷酸化后的Whi5亚型进行检测。Phos-tag的蛋白胶可以对以前观察不到的超磷酸化蛋白种类进行检测。作者们对细胞周期同步化后的细胞进行检测,发现在G1早期以及中期Whi5磷酸化水平变化不大,但在G1-S的过渡期Whi5会发生过度磷酸化,这可能是因为新合成的Cln1/2-Cdk1复合体开始发挥作用。为了对Cln3是否影响Whi5磷酸化进行探究,作者们在酵母细胞中敲除了Cln3,发现与未处理的细胞相比,Whi5低磷酸化水平(Hypophosphorylation)没有明显的变化。但是在G1晚期Whi5的超磷酸化水平(Hyperphosphorylation)出现了显著地延迟,但主要是因为上游Cln3-Cdk1活性缺失导致了Cln1/2-Cdk1表达的延迟。因此,作者们提出一个观点,即Cln1/2-Cdk1复合体完成了Whi5在G1晚期的超磷酸化,但G1早期Whi5的低磷酸化水平并不依赖于Cln3-Cdk1复合体。既然Cln3能够促进细胞周期的进入,但又不是通过对Whi5的磷酸化进行的,那么Cln3是如何调节SBP以及下游的基因表达的呢?为此,作者们进行了ChIP-seq(Chromatin immunoprecipitation sequencing),可以对Cln3对SBF复合体中组分的结合进行检测。作者们发现Cln3在68个基因启动子区域有结合,其中67个基因也被SBF所结合。Whi5在体内的磷酸化并不是由Cln3-Cdk1所进行的,说明Cln3-Cdk1可能是磷酸化了其他的、由SBF依赖的转录靶点。图1 Cln3-Cdk1复合体特异性磷酸化Pol II组分Rpb1为了找出Cln3-Cdk1复合体的磷酸化靶点,作者们希望纯化Cln3-Cdk1复合体。因此,作者们构建了一个甘氨酸-丝氨酸linker所连接的Cln3-Cdk1复合体,在蛋白质纯化之后这个linker可以被切割掉,并且同时保持这两种蛋白各自的生物学活性。通过体外纯化的蛋白,作者们首先确认了Cln3-Cdk1复合体并不能超磷酸化Whi5,而且也不是SBF相关蛋白中Swi6、Stb1以及Msa1的激酶。为此,作者们进行了一个候选靶点的筛选,从中发现了Cln3-Cdk1复合体磷酸化靶点是Pol II组分Rpb1(图1)。Rpb1 C末端CTD结构域(C-terminal unstructured region)包含多个七肽重复序列(Y1S2P3T4S5P6S7),该区域中不同该位点的磷酸化意味着转录过程的起始、延伸和终止【3】。通过突变重复多肽中的丝氨酸位点,作者们确认Cln3-Cdk1复合体磷酸化的是S5位点,并且在对七肽位点中的Y1、P3以及P6位点而非T4位点的突变会对S5位点的磷酸化有明显的影响,因为Cdk1是一个利用脯氨酸定位的激酶。由此,作者们确认Cln3-Cdk1复合体与其他的cyclin-Cdk复合物把不同的是它们通过特异性磷酸化RNA Pol II进而发挥在细胞周期中的作用的。另外通过在酵母中的遗传学实验以及雷帕霉素结合处理实验,作者们确认Cln3-Cdk1复合体对S5位点的磷酸化会影响对于SBF调节的基因的转录,从而确保细胞周期的稳健进行以及细胞尺寸的稳定。总的来说,该工作鉴定发现Cln3-Cdk1是通过Pol II CTD磷酸化促进基因表达的转录调控(图2),建立起了Cdks调节细胞分裂以及转录之间的联系,说明cyclin-Cdk复合物的功能远不止于细胞周期调控,其背后是更加精妙而复杂的调控网络。同期杂志中刊发了关于本工作的评述文章,题为A cell cycle regulator branches out,强调真核生物中关键的G1激酶以转录为靶点来驱动细胞周期进入的这一新细胞周期调控机制(图3)。在未来的研究中,参与转录的Cdks是否介入细胞周期功能以及各个成员之间的合作时序将是一个有趣的科学问题。此外,转录以及G1期蛋白Cdks也是癌症治疗的重要潜在药物靶点【4】,对于转录与细胞周期之间关系的探究将有助于指导药物的开发和联合疗法的发展。
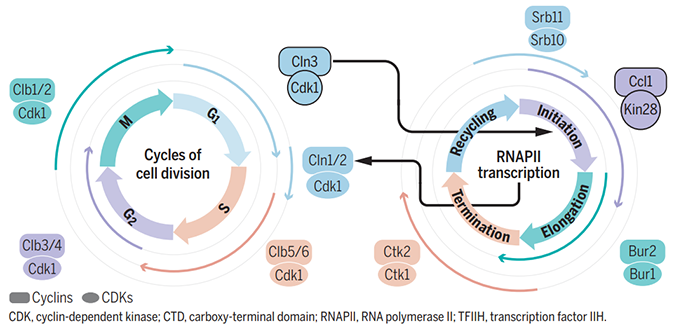
图3 cyclin-Cdk复合体磷酸化Pol II 组分Rpb1的CTD结构促进细胞周期转录的早期步骤进行
https://www.science.org/doi/full/10.1126/science.aba5186
1 Bertoli, C., Skotheim, J. M. & de Bruin, R. A. Control of cell cycle transcription during G1 and S phases. Nature reviews. Molecular cell biology 14, 518-528, doi:10.1038/nrm3629 (2013).2 Kinoshita, E., Kinoshita-Kikuta, E., Takiyama, K. & Koike, T. Phosphate-binding tag, a new tool to visualize phosphorylated proteins. Molecular & cellular proteomics : MCP 5, 749-757, doi:10.1074/mcp.T500024-MCP200 (2006).3 Harlen, K. M. & Churchman, L. S. The code and beyond: transcription regulation by the RNA polymerase II carboxy-terminal domain. Nature reviews. Molecular cell biology 18, 263-273, doi:10.1038/nrm.2017.10 (2017).4 Suski, J. M., Braun, M., Strmiska, V. & Sicinski, P. Targeting cell-cycle machinery in cancer. Cancer cell 39, 759-778, doi:10.1016/j.ccell.2021.03.010 (2021).